NG Matschke –
Metabolismus und
Strahlenantwort
Forschungsschwerpunkt
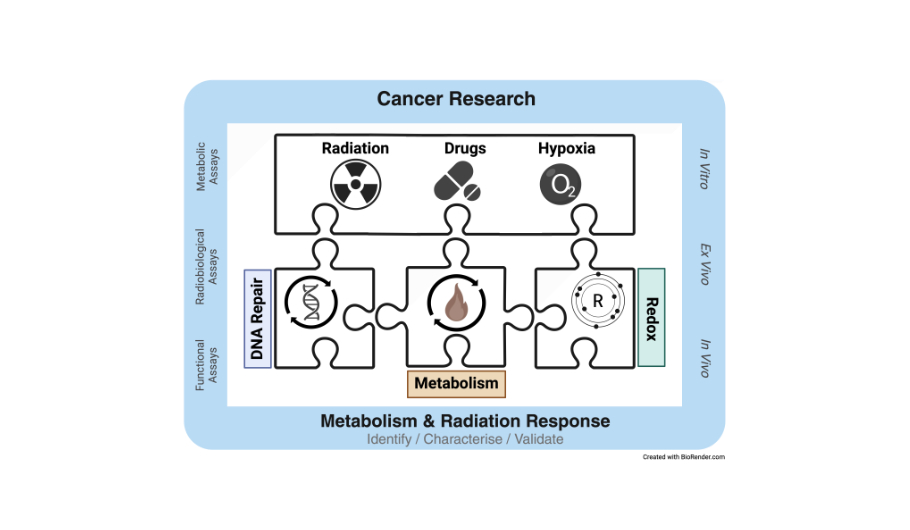
Die intra- und intertumorale Heterogenität des Stoffwechsels von Krebszellen und die Fähigkeit von Krebszellen ihren Stoffwechsel an Stressbedingungen in ihrer Umgebung anzupassen werden zunehmend als wichtige Determinanten der Resistenz von Krebszellen gegenüber einer Chemotherapie oder einer Bestrahlung erkannt. Allerdings sind die zugrundeliegenden Mechanismen und regulatorischen Netzwerke bisher jedoch nur unzureichend verstanden.
Die Nachwuchsgruppe „Metabolismus und Strahlenantwort“ untersucht die Ursachen der metabolischen Heterogenität und Plastizität von Tumorzellen und deren Bedeutung für die Strahlenresistenz von Krebszellen. Ziel dieser Arbeiten ist die Identifikation intrinsischer (genetisch bedingt), Mikromilieu- und Therapie-induzierter metabolischer Anpassungsreaktionen von Krebszellen mit Auswirkungen auf die Reparatur Therapie-induzierter DNA-Schäden und das Zellüberleben nach Bestrahlung. Diese sollen in der Folge auf ihre Eignung als therapeutische Zielstruktur zur Modulation der Strahlensensitivität bzw. als Marker der individuellen Strahlensensitivität überprüft werden.
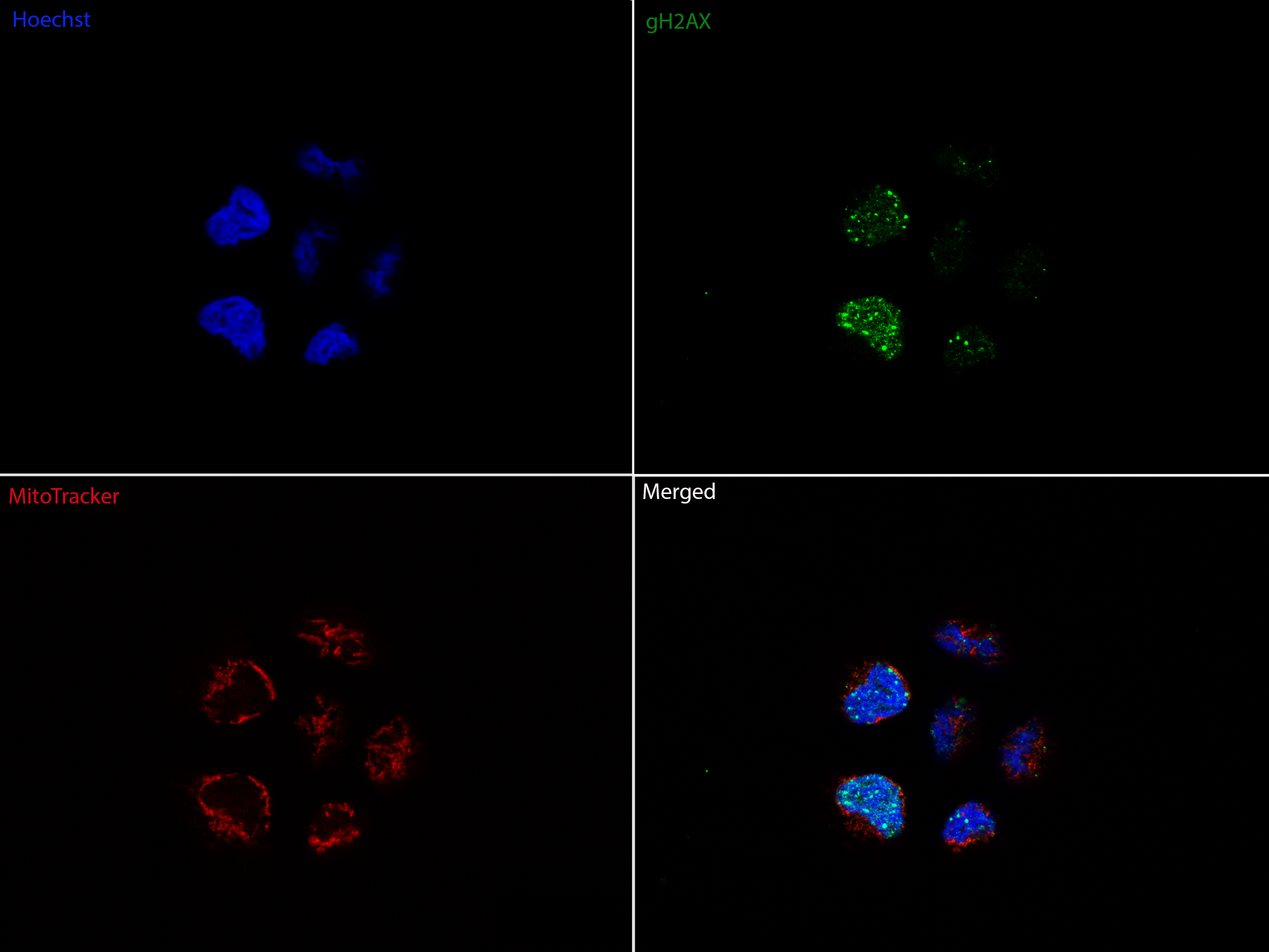
Methodisch kommen neben molekularbiologischen, zellbiologischen und strahlenbiologischen Methoden insbesondere verschiedene spezifische in vitro-Methoden zur Detektion von Stoffwechselmetaboliten sowie die nicht invasive Untersuchung metabolischer Parameter von Tumor- und Normalgewebszellen in Echtzeit (Seahorse Bioanalyser) unter Normoxie und Hypoxie zum Einsatz.

PD Dr. rer. nat.
Johann Matschke
Nachwuchsgruppenleiter
(Junior group leader)
Team

Julia Asche
Wissenschaftl. Doktorandin
(Scientific doctoral student)

Oleksandr Butenko
Medizinischer Doktorand
(Medical doctoral student)

Lingyi Cai
Medizinische Doktorandin
(Medical doctoral student)

Sarah Dörsam
Wissenschaftl. Doktorandin
(Scientific doctoral student)

Sarah Etemadi Afshar
Wissenschaftl. Doktorandin
(Scientific doctoral student)

Katharina Eul
Wissenschaftl. Doktorandin
(Scientific doctoral student)

Marvin Frölich
Medizinischer Doktorand
(Medical doctoral student)

Nikita Gorainow
Medizinischer Doktorand
(Medical doctoral student)

Razan Hessenow
Wissenschaftl. Doktorandin
(Scientific doctoral student)

Mikhail Kunin
Wissenschaftl. Doktorand
(Scientific doctoral student)

Rohit Mallick
Wissenschaftl. Doktorand
(Scientific doctoral student)

Merle Schaffrin
Medizinische Doktorandin
(Medical doctoral student)

Pankaj Singroul
Wissenschaftl. Doktorand
(Scientific doctoral student)
Aktuelle Projekte:
1. DFG-Graduiertenkolleg GRK 2762: Heterogenität, Plastizität und Dynamik der Reaktionen von Krebszellen, Tumoren und normalem Gewebe auf die Strahlentherapie bei Krebs.
Projekt L2: Identifizierung von subtypspezifischen metabolischen Schwachstellen bei KRAS-getriebenem NSCLC.
Das vorgeschlagene Projekt zielt darauf ab, die Auswirkungen des molekularen Hintergrunds, der durch klinisch relevante, gleichzeitig auftretende somatische Mutationen definiert ist, auf die Fähigkeit von KRAS-gesteuerten Lungenkrebszellen zu definieren, ihre Transkriptionsprogramme und metabolischen Phänotypen dynamisch anzupassen, um die DSB-Reparatur und das Überleben zu unterstützen, wenn sie ionisierender Strahlung (IR) ausgesetzt sind und durch unterschiedliche Umweltbedingungen gestört werden.
Doktorandin: Frau Sarah Etemadi Afshar (M. Sc.)
Projekt P1: Einfluss der KRAS-Gendosis und des molekularen Subtyps auf die Radiosensitivität bei PDAC.
Teilprojekt mit Prof. Dr. med. Jens Siveke und Prof. Dr. med. Beate Timmermann.
Das vorgeschlagene Projekt zielt darauf ab, ein Panel humaner PDAC-Zelllinien, die den klassischen und quasi-mesenchymalen (QM) Subtyp repräsentieren, auf ihre Reaktion auf Strahlentherapie (Photonen, Protonen) zu untersuchen, die dynamischen Veränderungen der Transkriptions- und Stoffwechselphänotypen nach der Strahlentherapie zu erfassen und zu untersuchen. Die computergestützte Modellierung der gewonnenen Daten soll es ermöglichen, subtypspezifische Biomarker und Ziele für die Modulation der Radiosensitivität zu ermitteln.
Doktorandin: Frau Julia Asche (M. Sc.)
2. BMBF-Verbundprojekt 02NUK090B „Neue innovative Strategien zur Radiosensitivierung von Medulloblastomen“.
Das vom BMBF geförderte Verbundprojekt mit dem Akronym NeuStaRT hat zum Ziel, neue zielgerichtete und innovative multimodale Therapiekonzepte zur Verbesserung der Prognose von Medulloblastom-Patienten zu entwickeln. Das Teilprojekt in Essen konzentriert sich auf die Identifizierung von Stoffwechselwegen, die mit der Strahlenantwort und dem subtypspezifischen therapeutischen Ansprechen auf die Strahlentherapie beim Medulloblastom assoziiert sind. Wir stellen die Hypothese auf, dass spezifische metabolische Anpassungen in Medulloblastom-Subgruppen deren Strahlensensitivität beeinflussen. Die gezielte Beeinflussung dieser dynamischen metabolischen Anpassungen könnte Medulloblastom-Zelllinien für PARP-Inhibitoren (PARPi) in Kombination mit Strahlentherapie (RT) sensitivieren und innovative, multimodale Therapieansätze ermöglichen.
Doktorand: Herr Rohit Mallick (M.Sc.)
3. DFG Projekt MA 8970/1-1
Metabolische Induktion von DNA-Reparaturdefekten zur Verbesserung der Effektivität einer Strahlentherapie.
Das Projekt zielt auf die Identifizierung metabolischer Engpässe ab, die die Reparatur strahleninduzierter letaler DNA-Läsionen in Krebszellen und damit das Überleben der Krebszellen limitieren und den Behandlungserfolg in Kombination mit einer Strahlentherapie verbessern.
Doktorand: Herr Mikhail Kunin
in Kooperation mit
Prof. Tomer Shlomi, Department of Computer Science and Biology & Lokey Center for Life Science and Engineering, Technion, Haifa, Israel (Nahost-Kooperation)
Prof. Nicole Dünker, Institut für Anatomie II, Abt. Neuroanatomie, Univ. Klinikum Essen
Prof. Ken Hermann, Abteilung für Nuklearmedizin, Univ. Klinikum Essen
4. EU Horizon 2020 Marie Sklodowska Curie Innovative Training Network (ITN) THERADNET (Grant Agreement No.86024) „International Network for Training and Innovations in Therapeutic Radiation“.
ESR11 Project „Targeting metabolic cancer cell plasticity to overcome escape from radiotherapy“.
Das Projekt untersucht den Einfluss des genetischen Hintergrundes von Krebszellen auf Adaptationsprozesse im Tumormetabolismus unter Hypoxie und Nähstoffentzug, und die Bedeutung der metabolischen Adaptation für die Strahlensensitivität.
Doktorandin: Frau Safa Larafa (M. Sc.)
5. BMBF-Verbundprojekt 02NUK061B „Einfluss veränderter Stoffwechselwege auf die therapeutische Strahlenantwort von Tumoren“
Das BMBF-geförderten Verbundprojekt mit dem Akronym METABOLiST zielt auf die Identifizierung von Stoffwechselprozessen ab, die die zelluläre Strahlenantwort und das Therapieansprechen in Kopf-Hals Tumoren beeinflussen, und daher potentiell als prädiktive Marker der Strahlensensitivität oder therapeutische Zielstrukturen zur Modulation der Strahlensensitivität geeignet sind.
Das Teilprojekt in Essen fokussiert auf die Identifizierung therapeutische Zielstrukturen und Wirkstoffe zur Beeinflussung der Strahlenantwort durch Modulation von Stoffwechselvorgängen.
Doktorandin: Frau Katharina Eul (M. Sc.)
6. Dr. Brigitte und Konstanze Wegener-StiftungProject zur Identifizierung metabolischer Abhängigkeiten im Kontext des molekularen Subtyps zur biologischen Individualisierung der Strahlentherapie bei Lungenkrebs. Förderdauer: 01.2022-03.2024
Intramurale Förderung:
1. WIR-Förderung der medizinischen Fakultät der Universität Duisburg-Essen: Translationales Projekt: „Validierung HIF-basierter Therapieansätze gegen die altersbedingte Makuladegeneration“ in Kooperation mit Dr. Y. Henning (Essen), Dr. G.E. Görtz (Essen). Förderdauer: 09.2021-08.2022
2. Deutsches Konsortium für Translationale Krebsforschung (DKTK): Translationales Projekt „Oncometabolomics of therapy resistance in Ewing Sarcoma“ in Kooperation mit Prof. U. Dirksen (Essen), Prof. M. Remke (Düsseldorf), Prof. S. Peña-Llopis (Essen), Förderdauer: 2019
