Labor Klein –
Vaskuläre Remodellierung
und Normalgewebsschutz
Forschungsschwerpunkt
Vaskuläre Funktion/Dysfunktion in Abhängigkeit von ionisierender Strahlung
Ziel der Strahlentherapie ist es die Tumorlast maximal zu reduzieren oder zu eliminieren während das Normalgewebe von Strahlungsschäden verschont bleiben soll. Aber die hohe Eigenempfindlichkeit bestimmter normaler Geweben begrenzt oft die Anwendung kurativer Strahlungsdosen, so dass ein Lokalrezidiv und Fernmetastasen auftreten können.
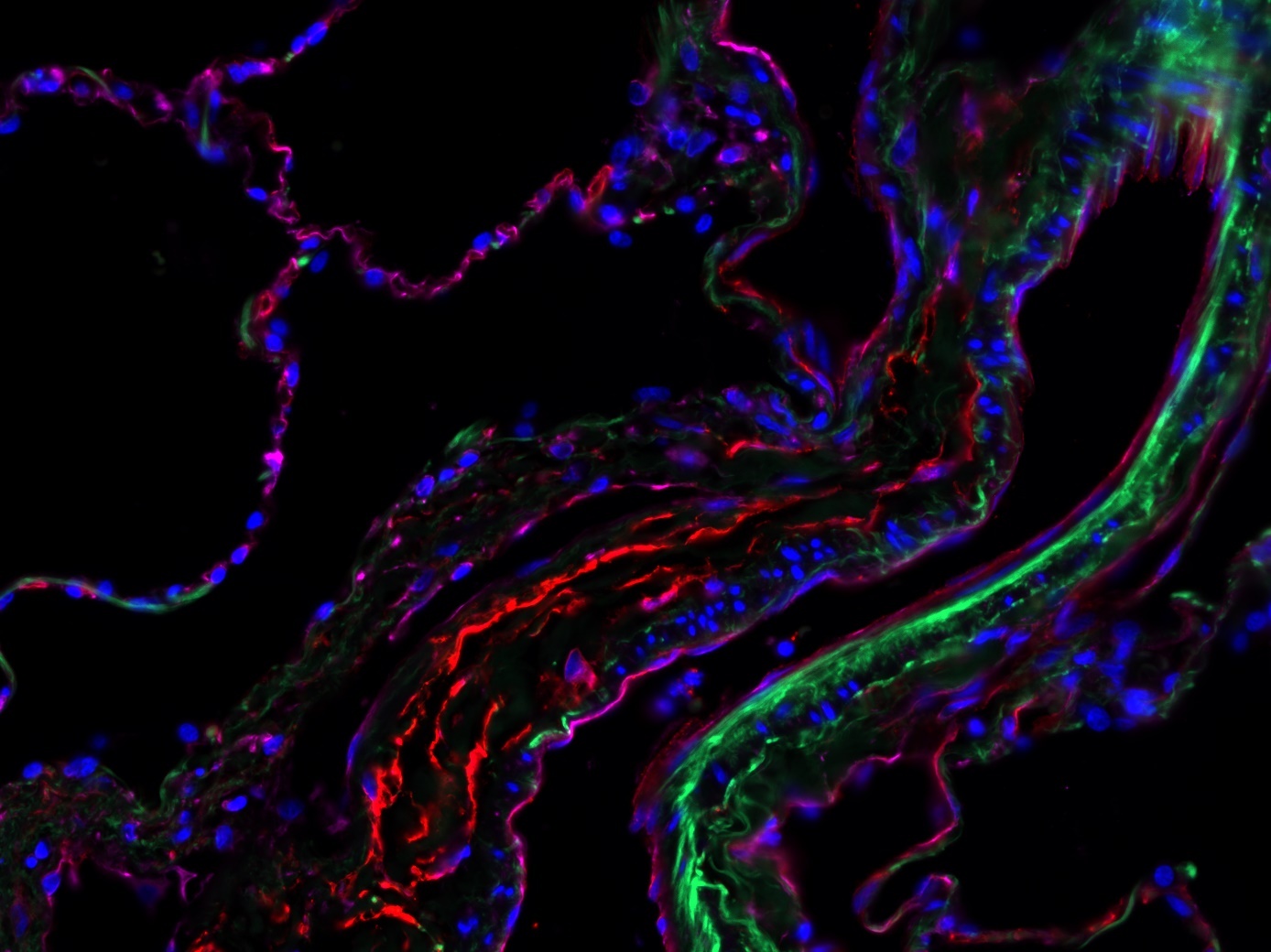
Ionisierende Strahlung führt zu DNA-Schäden wodurch in erster Linie schnell proliferierende Tumorzellen geschädigt und abgetötet werden. Darüber hinaus hat sich in den letzten Jahren gezeigt, dass den Blutgefäßen eine ganz entscheidende Rolle bei der Strahlenantwort zukommt und die Blutgefäße somit ein vielversprechendes therapeutisches Target sein könnten. Die Strahlungsempfindlichkeit der Blutgefäße scheint dabei entscheidend von der Morphologie und damit von der Größe des Blutgefäßes abzuhängen.
Der Fokus der Forschungsarbeiten dieser Nachwuchsgruppe liegt auf der Bedeutung der Endothelzellen und der der therapieinduzierten Gefäßremodellierung für die Radiosensitivität. Es wird versucht entscheidende Signalmoleküle und mögliche Therapie-Strategien zu identifizieren, die einerseits die Gefäße bzw. die Endothelzellen im Tumor radiosensitivieren (um die Effizienz der Strahlentherapie zu verbessern) bzw. anderseits die Endothelzellen im Normalgewebe während einer Bestrahlung zu schützen (um das Risiko von Strahlungs-induzierten Normalgewebsschäden zu minimieren).
Bzgl. der Radiosensitivierung von Tumorendothelzellen liegt der Fokus auf dem Membranprotein Caveolin 1 (Cav1). Bei verschiedenen Tumorentitäten und besonders beim Prostatakarzinom kann man eine ganz charakteristische Umverteilung von Caveolins beobachten: Während der Tumorprogression (angezeigt durch den Gleason score) kommt es zu einer verstärkten Expression von Caveolin im Epithel und die Cav1-Expression im reaktiven Tumorstroma nimmt ab. Dabei bleiben die stromalen Gefäße bzw. Endothelzellen von dieser Caveolin-Umverteilung verschont. Interessanterweise förderten Caveolin1-defiziente Endothelzellen im Tumor das Tumorwachstum, weil die neugebildeten Gefäße einen angiogenen, weniger stabilisierten Phänotyp besitzen und eine höhere Gefäßdichte im Tumor aufweisen. Im Gegensatz dazu zeigte sich eine erhöhte Wachstumsverzögerung nach Bestrahlung des Tumors, was auf eine erhöhte Apoptoserate von Cav1-defizienten Endothelzellen zurückzuführen war. Dies führt zur Hypothese, dass eine Reduktion von endothelialem Caveolin die Strahlenantwort im Tumor verbessern könnte. Detaillierte Untersuchungen zu den molekularen und zellulären Mechanismen Caveolin1-induzierter Veränderungen in der Radiosensitivität von Tumor- und Normalgewebszellen ist Gegenstand aktueller Untersuchungen in Teilprojekt 12 des gerade verlängerten Essener Graduiertenkollegs GRK1739.

Apl. Prof. Dr. rer. nat.
Diana Klein
Laborleiterin
(Head of laboratory)
Protektion von Normalgewebsschäden mittels mesenchymaler Stammzelltherapie
Der Anwendung einer kurativen Strahlendosis steht bei der Tumortherapie häufig die hohe intrinsische Empfindlichkeit des umgebenden Normalgewebes entgegen. Beispielsweise werden nach Thoraxbestrahlungen insbesondere entzündliche und fibrotische Veränderungen der Lunge als dosislimitierende Nebenwirkungen beobachtet. Derzeit ist keine ursächliche radioprotektive Behandlung verfügbar. Aktuelle Forschungsanstrengungen zielen daher darauf ab, das normale Gewebe während einer Radiotherapie zu schützen, um dadurch eine mögliche Steigerung der Strahlendosis zu erzielen.
Die Schädigung von Gefäß-Endothelien infolge einer Bestrahlung ist dabei wahrscheinlich ein zentrales Ereignis für die Pathogenese strahleninduzierter Normalgewebsschäden.In aktuellen Arbeiten untersuchen wir, inwiefern eine Therapie mit multipotenten mesenchymalen Stammzellen (MPSCs) strahleninduzierten vaskulären Schäden entgegenwirkt und damit einhergehenden Begleiterscheinungen (Pneumonitis, Fibrose) zu reduzieren vermag. Im Allgemeinen differenzieren Gewebe-spezifische Stammzellen vorwiegend zu dem Gewebetyp, dem sie entstammen; daher ist eine zentrale Arbeitshypothese, dass die therapeutische Applikation Gefäß-residenter multipotenter Stammzellen mesenchymaler Natur besonders gut geeignet sein könnte, um pathologische Prozesse an bestrahlten Blutgefäßen günstig zu beeinflussen.
Gefäß-residente MPSCs könnten für die autologe Stammzelltherapie beim Menschen von besonderem Interesse sein, da aus nur kleinen, wenigen Zentimeter langen Gefäßstücken vergleichbar mehr Zellen isoliert werden können als aus dem Knochenmark. Die Entnahme von Gefäßstücken etwa aus der Vena saphena oder aus der Arteria radialis wäre ein leicht auszuführender Eingriff. Die bisherigen Erfahrungen mit Gefäß-residenten Stammzellen zeigen weiterhin, dass diese relativ einfach aus der Gefäßwand isoliert und in Kultur expandiert werden können, um eine ausreichende Menge an Zellen für eine mögliche therapeutische Anwendung zu erhalten.
Team

Maja Buchholzki
Medizinische Doktorandin
(Medical doctoral student)

Luca Buttler
Studentische Hilfskraft
(Student assistent)

Lea Cremer
Bachelor Studentin
(Bachelor student)

Vaanilaa Ketheeswaranathan
Wissenschaftl. Doktorandin
(Scientific doctoral student)

Linus Korten
Technischer Mitarbeiter
(Technical assistent)

Fatma Zehra Sevendik
Studentische Hilfskraft
(Student assistent)

Lisa Stasch
Wissenschaftl. Doktorandin
(Scientific doctoral student)